Bài viết này sẽ giúp bạn hiểu rõ hơn về Sắt (Fe). Hãy cùng khám phá kiến thức về công thức hóa học, tính chất vật lí, hóa học, điều chế và sơ đồ tư duy của nguyên tố này.
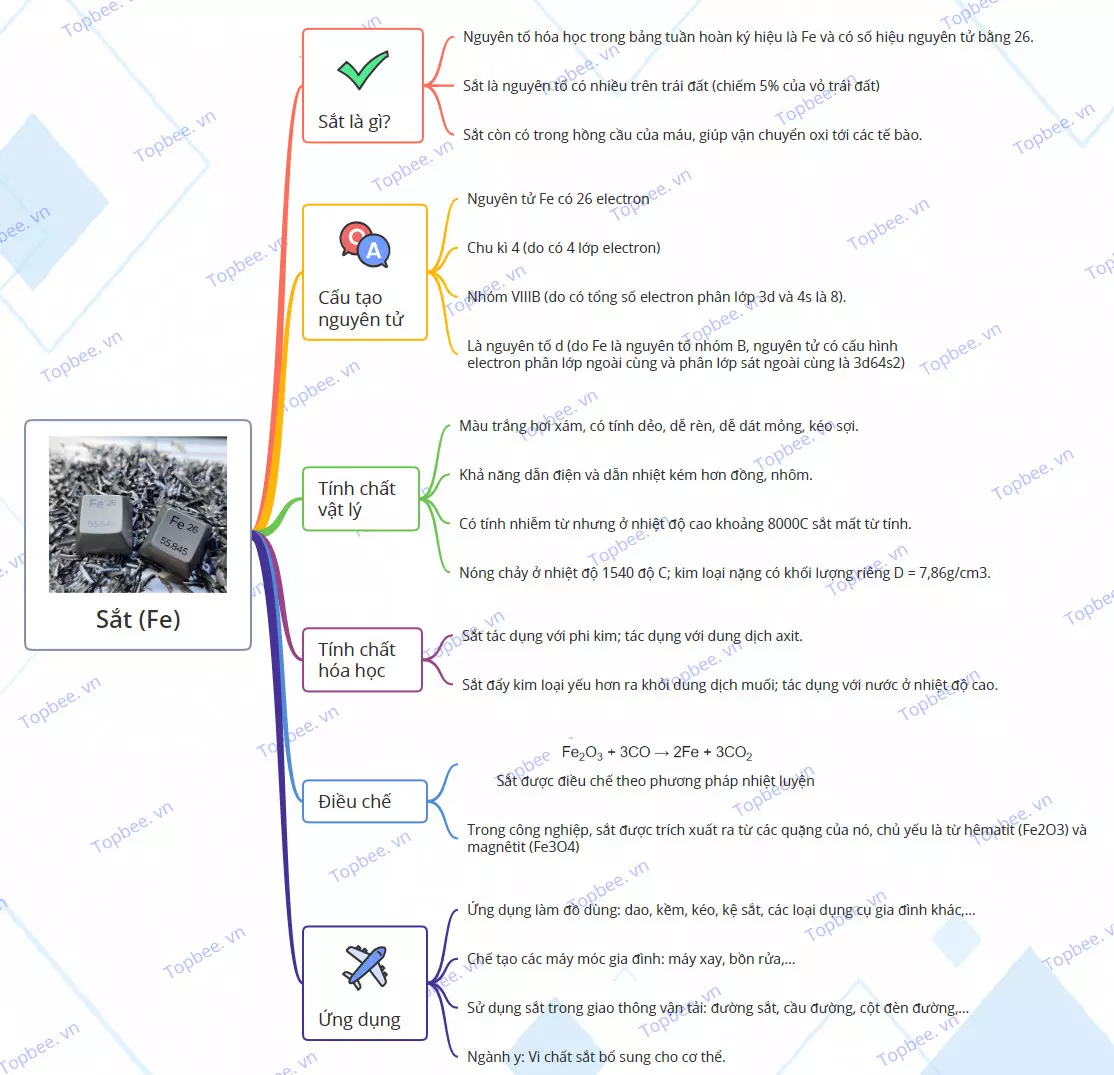
Sắt là gì?
- Sắt (Iron) là một nguyên tố hóa học trong bảng tuần hoàn, được ký hiệu là Fe và có số hiệu nguyên tử là 26.
- Trên trái đất, sắt là một nguyên tố phổ biến, chiếm 5% thành phần của vỏ trái đất và cấu thành lớp vỏ ngoài và vỏ trong của lõi trái đất.
- Có nhiều loại quặng sắt, bao gồm Hematit, Manhetit, Xiđerit và Pirit.
- Sắt còn có vai trò quan trọng trong hồng cầu máu, giúp vận chuyển oxy đến các tế bào.
Cấu tạo nguyên tử Sắt
- Nguyên tử sắt có 26 electron.
- Cấu hình electron của sắt thuộc chu kì 4 và nhóm VIIIB.
- Sắt là một nguyên tố nhóm B, có cấu hình electron phân lớp ngoài cùng là 3d6 4s2.
 Hình ảnh: Sắt Fe (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
Hình ảnh: Sắt Fe (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
Tính chất vật lý
- Sắt có màu trắng hơi xám và có tính dẻo, dễ rèn, dễ dát mỏng, kéo sợi.
- Sắt có khả năng dẫn điện và dẫn nhiệt kém hơn đồng và nhôm.
- Sắt có tính nhiễm từ, nhưng ở nhiệt độ cao khoảng 800°C, sắt mất từ tính.
- Nhiệt độ nóng chảy của sắt là 1540°C.
- Sắt có khối lượng riêng là 7,86g/cm3, là một kim loại nặng.
Tính chất hóa học
Sắt là một kim loại có tính khử trung bình. Trong các phản ứng hóa học, sắt tạo ra hợp chất với nguyên tử của các nguyên tố khác, và hóa trị của sắt là II hoặc III, tùy thuộc vào chất phản ứng ban đầu.
Sắt tác dụng với phi kim như Halogen (Br2, I2, Cl2,...), O2, S, và nhiều chất khác.
-
Sắt tác dụng với halogen: Tạo thành muối sắt (III) halogen.
- Ví dụ: 2Fe + 3Cl2 → 2FeCl3
-
Sắt tác dụng với oxi: Tạo thành oxit sắt (Fe3O4).
- Ví dụ: 3Fe + 2O2 → Fe3O4
-
Sắt tác dụng với lưu huỳnh:
- Ví dụ: Fe + S → FeS
Sắt cũng tác dụng với dung dịch axit như HCl, H2SO4 loãng, HNO3 và H2SO4 đặc, nóng.
-
Sắt tác dụng với dung dịch axit HCl, H2SO4 loãng:
- Ví dụ: Fe + 2HCl → FeCl2 + H2
- Ví dụ: Fe + H2SO4 loãng → FeSO4 + H2
-
Sắt tác dụng với axit HNO3, H2SO4 đặc, nóng:
- Ví dụ: Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
- Ví dụ: 2Fe + 6H2SO4 đặc, nóng → Fe2(SO4)3 + 3SO2 + 6H2O
Sắt còn có khả năng đẩy các kim loại yếu hơn ra khỏi dung dịch muối, tạo thành muối sắt tương ứng và giải phóng kim loại mới.
- Ví dụ: Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Sắt hầu như không tác dụng với nước lạnh, chỉ tác dụng khi đun nóng ở nhiệt độ cao.
- Ví dụ: 3Fe + 4H2O → Fe3O4 + 4H2
Điều chế
Sắt được điều chế theo phương pháp nhiệt luyện bằng cách khử quặng sắt bằng cacbon.
- Phương trình hóa học: Fe2O3 + 3CO → 2Fe + 3CO2
Trong công nghiệp, sắt được trích xuất từ các quặng như hêmatit (Fe2O3) và magnêtit (Fe3O4) trong lò luyện kim sử dụng luồng không khí nóng ở nhiệt độ khoảng 2000°C. Quặng sắt, cacbon và các chất tẩy tạp như đá vôi được xếp ở phía trên của lò, và luồng không khí nóng được đưa vào lò từ phía dưới.
Ứng dụng
Kim loại sắt được ứng dụng rộng rãi trong đời sống. Sắt chiếm khoảng 95% tổng khối lượng kim loại sản xuất trên toàn thế giới. Với giá thành thấp và độ bền cao, sắt được sử dụng trong sản xuất ô tô, thân tàu thủy lớn, các bộ khung cho các công trình xây dựng.
- Sắt được ứng dụng làm đồ dùng như dao, kềm, kéo, kệ sắt và các loại dụng cụ gia đình khác.
- Sắt được sử dụng để sản xuất đồ nội thất như bàn ghế, khung cửa, tủ kệ, cầu thang.
- Sắt được sử dụng trong việc chế tạo các máy móc gia đình như máy xay, bồn rửa.
- Sắt được sử dụng trong giao thông vận tải như đường sắt, cầu đường, cột đèn đường.
- Trong lĩnh vực y học, sắt được sử dụng để bổ sung cho cơ thể và làm nguyên liệu cho giường bệnh, tủ y tế, cây treo truyền dịch, xe đẩy và xe lăn.
Một số hợp chất
- Sắt (II) oxit (FeO): Là chất rắn màu đen, không tan trong nước. Sắt (II) oxit có tính oxi hóa và tính khử.
- Sắt (II) hiđroxit (Fe(OH)2): Là chất kết tủa màu trắng xanh, dễ bị oxi hóa chuyển sang màu nâu đỏ khi tiếp xúc với không khí. Sắt (II) hiđroxit là một bazơ không tan.
- Sắt (II) clorua (FeCl2): Là chất rắn thuận từ màu trắng hoặc xám. Trong không khí, sắt (II) clorua dễ bị chảy rữa và bị oxi hóa thành sắt (III).
- Sắt (III) oxit (Fe2O3): Là chất rắn nâu đỏ, không tan trong nước. Sắt (III) oxit có vai trò quan trọng trong việc tạo màu cho men gốm sứ.
- Sắt (III) hiđroxit (Fe(OH)3): Là một hidroxit có màu nâu đỏ, không tan trong nước. Sắt (III) hiđroxit có tính bazơ không tan.
- Sắt (III) nitrat (Fe(NO3)3): Là một hợp chất có khả năng hút ẩm tốt. Sắt (III) nitrat có tính oxi hóa và được sử dụng trong một số phản ứng tổng hợp.
Sơ đồ tư duy
Một số câu hỏi
Câu 1: Nguyên tử Fe có ký hiệu là gì?
A. Fe
B. Fe3+
C. Fe2+
D. Fe3+
Câu 2: Viết phương trình hóa học để tổng hợp Fe3O4 từ Fe và O2.
Câu 3: Để kết tủa hoàn toàn các ion trong dung dịch chứa Fe và Mg, cần bao nhiêu dung dịch NaOH 2M?
Câu 4: Tính số gam sắt và oxi cần dùng để điều chế được 2,32 gam oxi sắt từ Fe3O4.
Câu 5: Sau khi 5,6 gam Fe tan hoàn toàn trong dung dịch H2SO4 đặc nóng, thu được bao nhiêu lít SO2 (đktc)?
Hãy cùng khám phá thêm về nguyên tố Sắt (Fe) và kiến thức liên quan trong môn hóa học.
















